
AIHA也会增加脑卒中风险
AIHA可表现为原发性,也可表现为继发性AIHA合并其他免疫性或淋巴增殖性疾病。另一方面,此类患者的溶血过程主要发生在血管外,也涉及血管内溶血。溶血导致的游离血红蛋白的增加能够促进血管收缩和炎症,最终成为血栓形成的潜在诱发因素。已有研究证明AIHA患者发生静脉血栓形成的风险是普通人的2~3倍。现在,更有研究发现原发性AIHA患者发生缺血性脑卒中的风险也大大增加,一起来看看其中的细节吧!
医学科学家基于丹麦(人口580万)和法国(6740万)的两个全国性数据进行了这项研究,其中原发性AIHA组包括5994名患者(丹麦:1171人;法国:4823人),对照组为81525名按比例抽取的性别和年龄与患者相匹配的非AIHA正常人[丹麦:57773(1:50)人;法国:23752(1:5)人]。研究从患者初诊为AIHA起随访5年,或直到发生下列事件的一项:被诊断为中风、死亡、移民或研究期结束(丹麦:2016年12月31日;法国:2018年12月31日)。
AIHA患者中有130例中风(丹麦:34/1171|2.90%例;法国:96/4823|1.99%例),对照组中有1821例中风(丹麦:1395/57773|2.41%例;法国:426/23752|1.79%例)。在AIHA诊断后的第一年,15名丹麦患者患有缺血性中风,57名在法国AIHA队列中(对照队列:丹麦330名,法国133名)。在丹麦和法国,原发性AIHA患者和对照患者的1年累积卒中发病率分别为1.3%和0.6%,在法国分别为1.2%和0.6%,而后四年的发病率则没有差异。
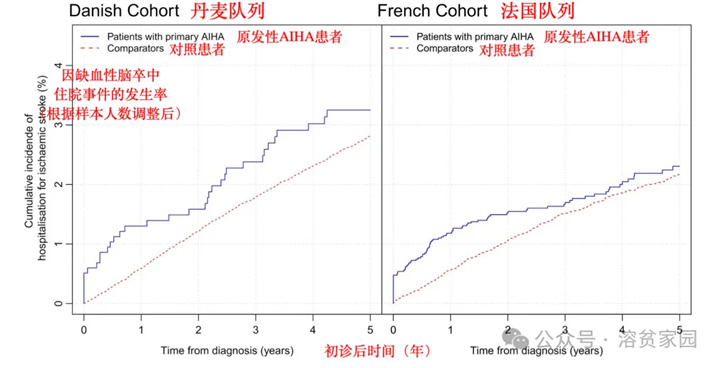
与对照队列相比,在第一年的随访中,缺血性中风累积发病率的差异更为显著。在限于1年随访的分析中,两个国家AIHA患者发生脑卒中的风险更高(调整后的整体风险比HR:2.29,95%CI:1.77-2.97),即是对照组的2.29倍。相反,仅限于后4年的分析结果表明AIHA组和对照组发生脑卒中的风险没有差别。
在诊断为原发性AIHA后的第一年内,发生缺血性卒中的风险增加。这一风险应在临床实践中也得到承认,因此应该控制发生缺血性卒中的其他危险因素。而由于丹麦和法国对慢性病(如高血压、糖尿病)的管理更好,因此,在我国的卒中风险可能更高。
另外,虽然研究中诊断为原发性AIHA后第一年卒中的发病率仅有约1.3%,看似很小,但在我国医疗分布不均的现状下,一旦发生,患者能够完全恢复的几率有限。据国内外研究报道,没有留下任何后遗症的缺血性脑卒中患者比例大约在10%到25%之间。常见的后遗症包括运动功能障碍、言语障碍、认知障碍、情绪障碍等。
由于研究数据的局限,患者有关AIHA治疗状况不全,因此无法推断AIHA的缺血性中风风险增加是否直接源于AIHA的溶血过程、自身免疫失调或医疗管理。而另一方面,AIHA患者中所有类型血栓栓塞症的较高患病率可能表明中风风险的增加是自身免疫过程和溶血的结果。另外,根据患者和医疗体系对心脑血管疾病的重视情况和治疗状况的不同,可能也给研究数据带来了一些误差,因为很多心脑血管病如冠心病,房颤等也是缺血性脑卒中的重要危险因素。
●积极治疗AIHA,控制溶血现象,避免急性溶血:AIHA能够增加缺血性卒中的风险,其中溶血造成的继发性高凝血状态对卒中的发生具有重要意义,因此控制原发病是AIHA患者最重要的治疗。
●在诊断为AIHA的第一年适当服用抗凝/抗血小板药物,如华法林、氯吡格雷。注意要注意在医生的指导和凝血功能监测下进行,避免出血的不良事件。
●日常注意监测纤维蛋白原(正常值为2-4g/L)、D-2聚体数值(正常值为0-0.5mg/L)以及凝血功能。
●积极治疗其他易致血栓或容易导致血液高凝状态的疾病,例如高血压、糖尿病、高脂血症,将各项指标控制在正常范围内。
●适当进行体育运动,戒烟戒酒,均衡饮食,维持健康的体重,都有助于血栓的预防。
总而言之,该研究表明,在AIHA确诊后的第一年进行抗凝治疗可能具有潜在的有益效果。不过,这究竟对之后AIHA的治疗有什么影响,还需要更多的研究来支持。
参考文献:
[1]Hansen DL, Maquet J, Lafaurie M, Möller S, Berentsen S, Frederiksen H, Moulis G, Gaist D. Primary autoimmune haemolytic anaemia is associated with increased risk of ischaemic stroke: A binational cohort study from Denmark and France. Br J Haematol. 2023 Dec 14.
如果大家想进一步交流血液疾病的相关问题,可以微信扫一扫下图二维码,加入我们的病友群。申请好友时请备注疾病类型。














